
Faculté de médecine Pierre et Marie Curie – Site Saint-Antoine – 11ème étage
27, rue Chaligny – 75571 PARIS cedex 12
Notre équipe étudie les mécanismes moléculaires et cellulaires du vieillissement et de la longévité. Nous cherchons à mieux comprendre les processus fondamentaux du vieillissement et comment ils impactent l'étiologie et la progression des maladies liées à l’âge, comme la maladie d'Alzheimer, une neurodégénérescence très fréquente chez les sujets âgés.
Nos études se concentrent sur le rôle des insulin-like growth factors IGF-I et -II, et de leur récepteur spécifique IGF-1R dans la longévité des mammifères. Nous avons montré que la signalisation IGF exerce non seulement un contrôle étroit sur la croissance postnatale, mais régule aussi très efficacement le vieillissement cellulaire et celui de l'organisme. Spécifiquement, nous avons montré que limiter l’activation du récepteur des IGF prolonge la durée de vie et améliore la résistance au stress(Holzenberger et al. 2003, Xu et al. 2014). Nous avons aussi montré que la plasticité fonctionnelle de l’axe neuroendocrine somatotrope est essentielle pour la longévité (Kappeler et al. 2008). Tout de même, les mécanismes cellulaires par lesquels la signalisation IGF contrôle la trajectoire du vieillissement des différents tissus et organes sont encore très mal connus. Récemment, nous avons démontré que la suppression des signaux IGF dans les cellules souches neuronales (NSC) prévient la déplétion des précurseurs neuronaux et maintient le pool de ces cellules souches dans un état jeune, à l'intérieur d'un cerveau vieillissant (Chaker et al. 2015, Chaker et al. 2016). Ces résultats surprenants sont soutenus par des donnés obtenus par modélisation mathématique, qui prédit qu’une diminution de la stimulation de la croissance serait effectivement optimale pour un meilleur vieillissement tissulaire. En résumé, la suppression dans les NSC adultes du gène de la croissance et de la longévité IGF-1R induit un phénotype de gain de fonction au cours du vieillissement, qui est marqué par une gestion optimisée du renouvellement cellulaire, par un phénotype mince et par une fonction olfactive améliorée. Ces résultats ont mis en évidence pour la première fois que la signalisation IGF coordonne le remplacement cellulaire à long terme in vivo, et suggère que les voies de signalisation IGF contrôlent simultanément deux mécanismes majeurs de la longévité: la résistance cellulaire et le remplacement cellulaire au sein des tissus. Aujourd’hui, nous élargissons cet axe de recherche dans un nouveau modèle conditionnel appelé UBIKOR (François et al. 2017).
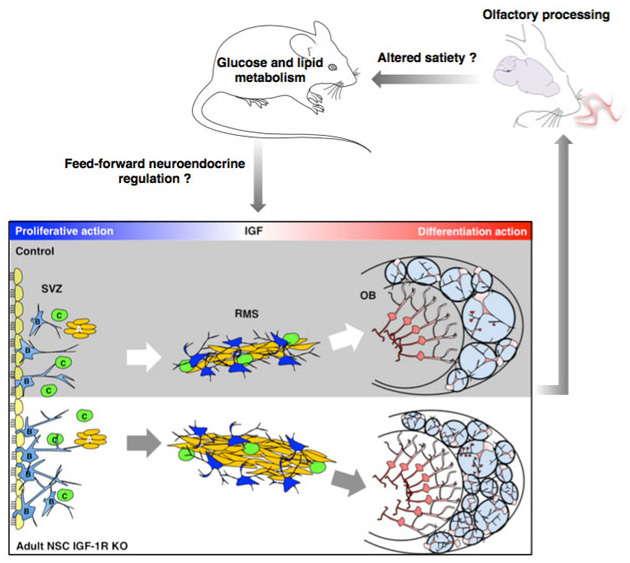 Fig.1 - We induced IGF-1R knockout selectively in adult neuronal stem cells and found that this enhanced long-term neurogenesis in the olfactory cortex. Concomitant with the integration of many additional IGF-1R knockout neurons, olfactory function improved and male mutants progressively developed a prominent metabolic phenotype. Aged mutants were leaner and exerted tighter control over glucose metabolism. In fact, high prevalence of IGF-1R resistant neurons in the adult olfactory bulb mimics effects of food scarcity in an important sensory region of the brain. Consistently, mutants show phenotypic changes typical for systemic adaption to caloric restriction. Question marks indicate hypothetical mechanistic links between OB neurogenesis and metabolic phenotype. More details are in Chaker et al., Aging Cell 2015.
Fig.1 - We induced IGF-1R knockout selectively in adult neuronal stem cells and found that this enhanced long-term neurogenesis in the olfactory cortex. Concomitant with the integration of many additional IGF-1R knockout neurons, olfactory function improved and male mutants progressively developed a prominent metabolic phenotype. Aged mutants were leaner and exerted tighter control over glucose metabolism. In fact, high prevalence of IGF-1R resistant neurons in the adult olfactory bulb mimics effects of food scarcity in an important sensory region of the brain. Consistently, mutants show phenotypic changes typical for systemic adaption to caloric restriction. Question marks indicate hypothetical mechanistic links between OB neurogenesis and metabolic phenotype. More details are in Chaker et al., Aging Cell 2015.
Récemment, nous avons aussi montré que le blocage de la signalisation IGF dans les neurones adultes réduit significativement la pathologie de type Alzheimer, par une amélioration de la clairance du peptide amyloïde β (Gontier et al. 2015). La maladie d’Alzheimer (MA) est une neurodégénérescence fréquente et irréversible, qui reste aujourd’hui sans traitement efficace. Expérimentalement, une diminution globale de la signalisation IGF améliore les symptômes de souris modélisant la MA (Cohen et al. 2009). Nous avons fait l'hypothèse que rendre spécifiquement les neurones adultes résistants à la signalisation IGF permettrait de protéger le cerveau vieillissant de cette maladie neurologique fatale. Pour cela, nous avons supprimé spécifiquement l’IGF-1R des neurones adultes de souris transgéniques modélisant la MA : avec l'âge, leur cerveau accumule progressivement des plaques amyloïdes associées à une neuroinflammation et des déficits cognitifs. Or, les souris mutantes Alzheimer déficientes en IGF-1R neuronal montrent une mémorisation spatiale améliorée; leurs cerveaux présentent moins de plaques amyloïdes, moins d’agrégats du peptide amyloïde β (Aβ), et une moindre neuroinflammation. Nous avons démontré pour la première fois que la signalisation IGF exerce des effets majeurs sur l'homéostasie protéique neuronale et la maintenance de la morphologie cellulaire in vivo (Gontier et al. 2015). En même temps, les niveaux circulants d’Aβ sont clairement augmentés. Ensemble, nos données indiquent que l’ablation d’IGF-1R neuronal confère une protection durable contre la MA par une meilleure clairance d’Aβ toxique, par une meilleure préservation du compartiment autophagique et par une meilleure élimination systémique d’Aβ. En plus, la comparaison fonctionnelle des profils transcriptomiques des neurones à des stades précoces de la pathologie amyloïde avec des neurones déficients en IGF-1R révèle une forte convergence des signatures transcriptomiques. Ces données récentes suggèrent que, dans les phases précoces de la maladie, un neurone qui fait face à une protéinopathie A réussit à mettre en place une réponse endogène qui mime celle d'un neurone dépourvu d'IGF-1R (George et al. 2017). Dans l'ensemble, nos résultats soulignent que l'IGF-1R neuronal et ses voies de signalisation en aval sont des cibles prometteuses pour le traitement de la MA.
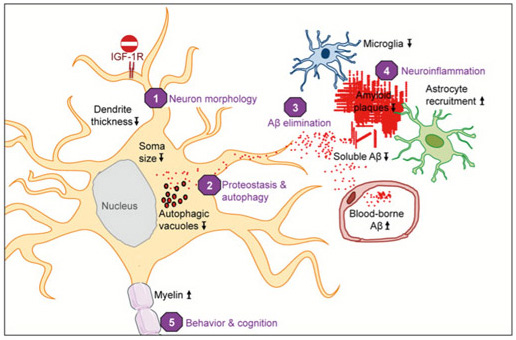
Fig.2 - Neuronal IGF-1R signaling impacts AD progression in multiple ways. Blocking IGF-1R signaling in adult neurons affects cell maintenance and protein homeostasis. Neurons change to a more compact soma and leaner dendrites (1). Autophagy defects in AD, characterized by accumulation of Aβ containing autophagic vacuoles, normalize after IGF-1R inactivation (2). IGF-1R inactivation does not change APP production or processing. Significantly less insoluble Aβ (fewer plaques) and markedly diminished soluble Aβ point to facilitated clearance of toxic peptides from the brain (3). Consequently, neuronal microenvironment is less toxic, as reflected by preserved myelin content and diminished microglial infiltration, possibly preventing less of neurons (4). Cytoarchitectural and functional changes observed after neuronal IGF-1R inactivation in the forebrain of AD improve behavioral and cognitive performances (5). Several different processes are improved in the absence of IGF signaling, suggesting that neuroprotective mechanisms are well adapted to low somatotropic tone.
En résumé, notre équipe a identifié les voies de signalisation IGF comme régulateurs clés de plusieurs processus interagissant dans le contrôle du vieillissement. Nous nous concentrons depuis sur (1) l’impact de la signalisation IGF sur l’homéostasie tissulaire au cours du vieillissement, (2) sur les mécanismes neuroprotecteurs de la résistance aux IGF dans les maladies neurodégénératives de type Alzheimer, et (3) sur le rôle de l’hormone de croissance et de la signalisation IGF dans la coordination de la santé et la longévité.
 The developmental basis for scaling of mammalian tooth size. Christensen MM, Hallikas O, Das Roy R, Väänänen V, Stenberg OE, Häkkinen TJ, François JC, Asher RJ, Klein OD, Holzenberger M, Jernvall J. Proc Natl Acad Sci U S A (2023) 120 e2300374120. doi: 10.1073/pnas.2300374120.
The developmental basis for scaling of mammalian tooth size. Christensen MM, Hallikas O, Das Roy R, Väänänen V, Stenberg OE, Häkkinen TJ, François JC, Asher RJ, Klein OD, Holzenberger M, Jernvall J. Proc Natl Acad Sci U S A (2023) 120 e2300374120. doi: 10.1073/pnas.2300374120.
https://www.pnas.org/doi/10.1073/pnas.2300374120
 IGF1R suppression in the kidney podocyte has beneficial and detrimental consequences dependent on the level of inhibition. Hurcombe JA, Barrington F, Marchetti M, Betin VMS, Bowen EE, Lay AC, Ni L, Dayalan L, Pope RJP, Brinkkoetter PT, Holzenberger M, Welsh GI, Coward RJM. iScience (2023), accepted manuscript.
IGF1R suppression in the kidney podocyte has beneficial and detrimental consequences dependent on the level of inhibition. Hurcombe JA, Barrington F, Marchetti M, Betin VMS, Bowen EE, Lay AC, Ni L, Dayalan L, Pope RJP, Brinkkoetter PT, Holzenberger M, Welsh GI, Coward RJM. iScience (2023), accepted manuscript.
 IGF-1 receptor regulates upward firing rate homeostasis via the mitochondrial calcium uniporter. Katsenelson M, Shapira I, Abbas E, Jevdokimenko K, Styr B, Ruggiero A, Aïd S, Fornasiero EF, Holzenberger M, Rizzoli SO, Slutsky I. Proc Natl Acad Sci U S A (2022) 119 e2121040119. doi: 10.1073/pnas.2121040119.
IGF-1 receptor regulates upward firing rate homeostasis via the mitochondrial calcium uniporter. Katsenelson M, Shapira I, Abbas E, Jevdokimenko K, Styr B, Ruggiero A, Aïd S, Fornasiero EF, Holzenberger M, Rizzoli SO, Slutsky I. Proc Natl Acad Sci U S A (2022) 119 e2121040119. doi: 10.1073/pnas.2121040119.
https://www.pnas.org/doi/10.1073/pnas.2121040119
 PTBP1 promotes hematopoietic stem cell maintenance and red blood cell development by ensuring sufficient availability of ribosomal constituents. Rehn M, Wenzel A, Frank AK, Schuster MB, Pundhir S, Jørgensen N, Vitting-Seerup K, Ge Y, Jendholm J, Michaut M, Schoof EM, Jensen TL, Rapin N, Sapio RT, Andersen KL, Lund AH, Solimena M, Holzenberger M, Pestov DG, Porse BT. Cell Rep (2022) 39(6):110793. doi: 10.1016/j.celrep.2022.110793.
PTBP1 promotes hematopoietic stem cell maintenance and red blood cell development by ensuring sufficient availability of ribosomal constituents. Rehn M, Wenzel A, Frank AK, Schuster MB, Pundhir S, Jørgensen N, Vitting-Seerup K, Ge Y, Jendholm J, Michaut M, Schoof EM, Jensen TL, Rapin N, Sapio RT, Andersen KL, Lund AH, Solimena M, Holzenberger M, Pestov DG, Porse BT. Cell Rep (2022) 39(6):110793. doi: 10.1016/j.celrep.2022.110793.
https://pubmed.ncbi.nlm.nih.gov/35545054/
 Thyrocyte-specific deletion of insulin and IGF-1 receptors induces papillary thyroid carcinoma-like lesions through EGFR pathway activation. Ock S, Ahn J, Lee SH, Kim HM, Kang H, Kim YK, Kook H, Park WJ, Kim S, Kimura S, Jung CK, Shong M, Holzenberger M, Abel ED, Lee TJ, Cho BY, Kim HS, Kim J. Int J Cancer (2018) 143(10):2458-2469. doi: 10.1002/ijc.31779.
Thyrocyte-specific deletion of insulin and IGF-1 receptors induces papillary thyroid carcinoma-like lesions through EGFR pathway activation. Ock S, Ahn J, Lee SH, Kim HM, Kang H, Kim YK, Kook H, Park WJ, Kim S, Kimura S, Jung CK, Shong M, Holzenberger M, Abel ED, Lee TJ, Cho BY, Kim HS, Kim J. Int J Cancer (2018) 143(10):2458-2469. doi: 10.1002/ijc.31779.
https://pubmed.ncbi.nlm.nih.gov/30070361/
 CaMKIIα Expression Defines Two Functionally Distinct Populations of Granule Cells Involved in Different Types of Odor Behavior. Malvaut S, Gribaudo S, Hardy D, David LS, Daroles L, Labrecque S, Lebel-Cormier MA, Chaker Z, Coté D, De Koninck P, Holzenberger M, Trembleau A, Caille I, Saghatelyan A. Curr Biol (2017) 27(21):3315-3329.e6. doi: 10.1016/j.cub.2017.09.058.
CaMKIIα Expression Defines Two Functionally Distinct Populations of Granule Cells Involved in Different Types of Odor Behavior. Malvaut S, Gribaudo S, Hardy D, David LS, Daroles L, Labrecque S, Lebel-Cormier MA, Chaker Z, Coté D, De Koninck P, Holzenberger M, Trembleau A, Caille I, Saghatelyan A. Curr Biol (2017) 27(21):3315-3329.e6. doi: 10.1016/j.cub.2017.09.058.
https://pubmed.ncbi.nlm.nih.gov/29107547/
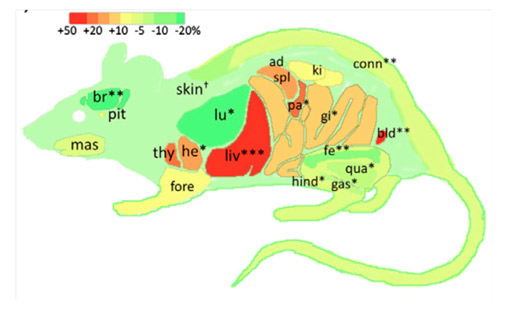 –Disrupting IGF Signaling in Adult Mice Conditions Leanness, Resilient Energy Metabolism, and High Growth Hormone Pulses. François JC, Aïd S, Chaker Z, Lacube P, Xu J, Fayad R, Côté F, Even P, Holzenberger M. Endocrinology (2017) 158: 2269-2283.
–Disrupting IGF Signaling in Adult Mice Conditions Leanness, Resilient Energy Metabolism, and High Growth Hormone Pulses. François JC, Aïd S, Chaker Z, Lacube P, Xu J, Fayad R, Côté F, Even P, Holzenberger M. Endocrinology (2017) 158: 2269-2283.
https://academic.oup.com/endo/article/158/7/2269/3813249
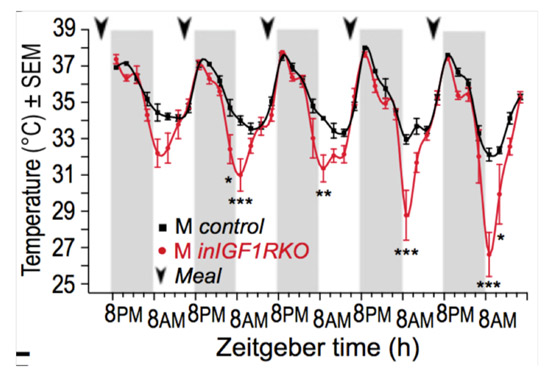 Insulin-like growth factor 1 receptor regulates hypothermia during calorie restriction. Cintron-Colon R, Sanchez-Alavez M, Nguyen W, Mori S, Gonzalez-Rivera R, Lien T, Bartfai T, Aïd S, François JC, Holzenberger M, Conti B. Proc Natl Acad Sci U S A (2017) 114: 9731-9736.
Insulin-like growth factor 1 receptor regulates hypothermia during calorie restriction. Cintron-Colon R, Sanchez-Alavez M, Nguyen W, Mori S, Gonzalez-Rivera R, Lien T, Bartfai T, Aïd S, François JC, Holzenberger M, Conti B. Proc Natl Acad Sci U S A (2017) 114: 9731-9736.
https://www.pnas.org/content/114/36/9731
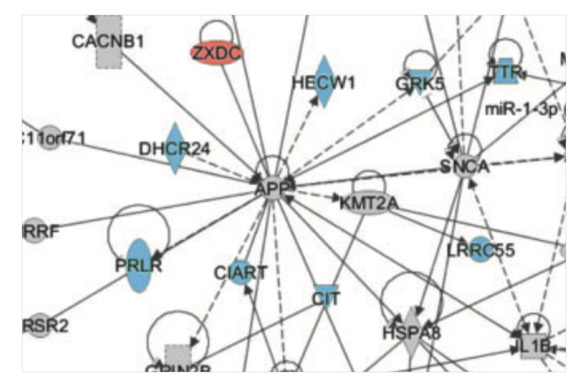 The Alzheimer's disease transcriptome mimics the neuroprotective signature of IGF-1 receptor-deficient neurons. George C, Gontier G, Lacube P, François JC, Holzenberger M, Aïd S. Brain (2017) 140: 2012-2027.
The Alzheimer's disease transcriptome mimics the neuroprotective signature of IGF-1 receptor-deficient neurons. George C, Gontier G, Lacube P, François JC, Holzenberger M, Aïd S. Brain (2017) 140: 2012-2027.
https://academic.oup.com/brain/article/140/7/2012/3864005
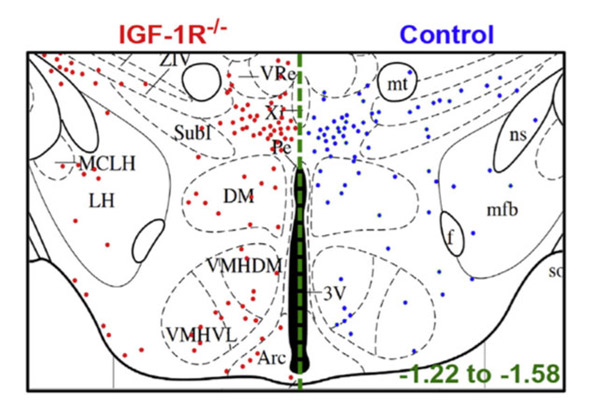 Hypothalamic neurogenesis persists in the aging brain and is controlled by energy-sensing IGF-I pathway. Chaker Z, Petrovska M, Caron JB, Lacube P, Caillé I, Holzenberger M (2016) Neurobiol Aging 41: 64-72.
Hypothalamic neurogenesis persists in the aging brain and is controlled by energy-sensing IGF-I pathway. Chaker Z, Petrovska M, Caron JB, Lacube P, Caillé I, Holzenberger M (2016) Neurobiol Aging 41: 64-72.
https://www.sciencedirect.com/science/article/abs/pii/S0197458016001512?via%3Dihub
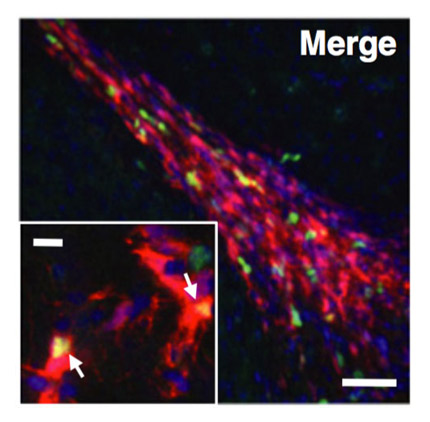
 Publi 5.jpeg Deleting IGF-1 receptor from forebrain neurons confers neuroprotection during stroke and upregulates endocrine somatotropin. De Magalhaes Filho CD, Kappeler L, Dupont J, Solinc J, Villapol S, Denis C, Nosten-Bertrand M, Billard JM, Blaise A, Tronche F, Giros B, Charriaut-Marlangue C, Aïd S, Le Bouc Y, Holzenberger M. J Cerebr Blood Flow Metab (2017) 37: 396-412.
Publi 5.jpeg Deleting IGF-1 receptor from forebrain neurons confers neuroprotection during stroke and upregulates endocrine somatotropin. De Magalhaes Filho CD, Kappeler L, Dupont J, Solinc J, Villapol S, Denis C, Nosten-Bertrand M, Billard JM, Blaise A, Tronche F, Giros B, Charriaut-Marlangue C, Aïd S, Le Bouc Y, Holzenberger M. J Cerebr Blood Flow Metab (2017) 37: 396-412.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5381438/
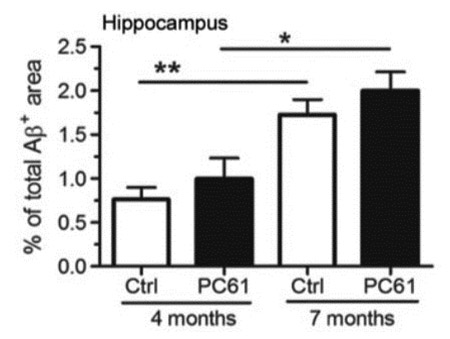 Regulatory T cells delay disease progression in Alzheimer-like pathology. Dansokho C, Ait Ahmed D, Aïd S, Toly-Ndour C, Chaigneau T, Calle V, Cagnard N, Holzenberger M, Piaggio E, Aucouturier P, Dorothée G. Brain (2016) 139: 1237-1251.
Regulatory T cells delay disease progression in Alzheimer-like pathology. Dansokho C, Ait Ahmed D, Aïd S, Toly-Ndour C, Chaigneau T, Calle V, Cagnard N, Holzenberger M, Piaggio E, Aucouturier P, Dorothée G. Brain (2016) 139: 1237-1251.
https://academic.oup.com/brain/article/139/4/1237/2464189
 Blocking IGF signaling in adult neurons alleviates Alzheimer’s disease pathology through amyloid-β clearance. Gontier G, George C, Chaker Z, Holzenberger M, Aïd S. J Neurosci (2015) 35: 11500-11513.
Blocking IGF signaling in adult neurons alleviates Alzheimer’s disease pathology through amyloid-β clearance. Gontier G, George C, Chaker Z, Holzenberger M, Aïd S. J Neurosci (2015) 35: 11500-11513.
http://www.jneurosci.org/content/35/33/11500.long
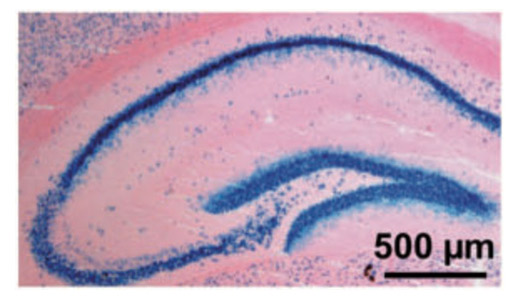
 Suppression of IGF-I signals in neural stem cells enhances neurogenesis and olfactory function during aging. Chaker Z, Aïd S, Berry H, Holzenberger M. Aging Cell (2015) 14: 847-856.
Suppression of IGF-I signals in neural stem cells enhances neurogenesis and olfactory function during aging. Chaker Z, Aïd S, Berry H, Holzenberger M. Aging Cell (2015) 14: 847-856.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4568972/
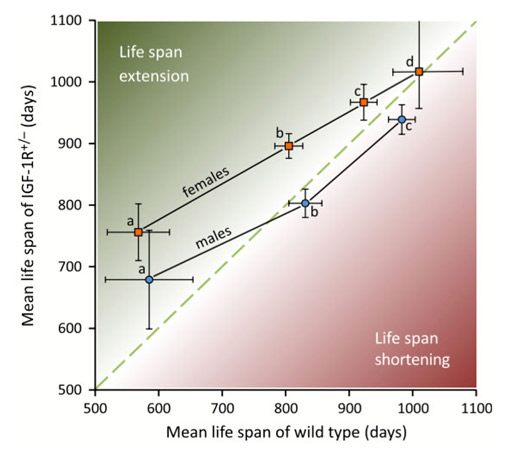 Longevity effect of IGF-1R+/- mutation depends on genetic background-specific receptor activation. Xu J, Gontier G, Chaker Z, Lacube P, Dupont J, Holzenberger M. Aging Cell (2014) 13: 19-28.
Longevity effect of IGF-1R+/- mutation depends on genetic background-specific receptor activation. Xu J, Gontier G, Chaker Z, Lacube P, Dupont J, Holzenberger M. Aging Cell (2014) 13: 19-28.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4326867/
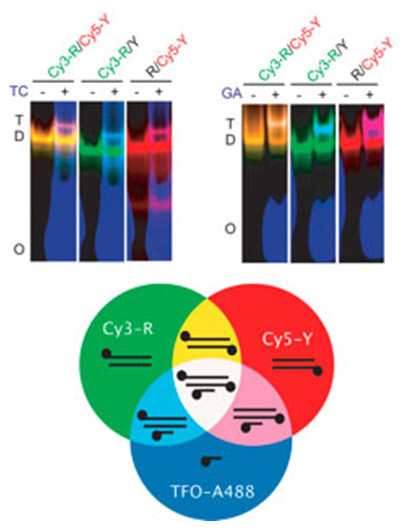 Monitoring DNA triplex formation using multicolor fluorescence and application to insulin-like growth factor I promoter downregulation. Hégarat N, Novopashina D, Fokina AA, Boutorine AS, Venyaminova AG, Praseuth D, François JC. FEBS J (2014) 281: 1417-1431.
Monitoring DNA triplex formation using multicolor fluorescence and application to insulin-like growth factor I promoter downregulation. Hégarat N, Novopashina D, Fokina AA, Boutorine AS, Venyaminova AG, Praseuth D, François JC. FEBS J (2014) 281: 1417-1431.
http://www.onlinelibrary.wiley.com/doi/10.1111/febs.12714/full
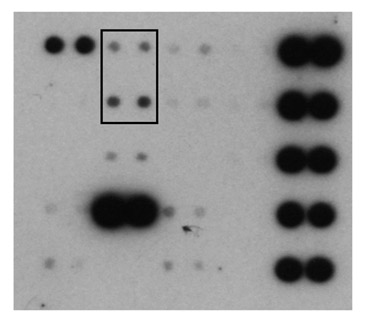 Small interfering RNA targeted to IGF-IR delays tumor growth and induces proinflammatory cytokines in a mouse breast cancer model. Durfort T, Tkach M, Meschaninova MI, Rivas MA, Elizalde PV, Venyaminova AG, Schillaci R, François JC. PLoS ONE (2012) 7: e29213.
Small interfering RNA targeted to IGF-IR delays tumor growth and induces proinflammatory cytokines in a mouse breast cancer model. Durfort T, Tkach M, Meschaninova MI, Rivas MA, Elizalde PV, Venyaminova AG, Schillaci R, François JC. PLoS ONE (2012) 7: e29213.
http://www.journals.plos.org/plosone/article?id=10.1371/journal.pone.0029213
 Exploring endocrine GH pattern in mice using rank plot analysis and random blood samples. Xu J, Bekaert AJ, Dupont J, Rouve S, Annesi-Maesano I, De Magalhaes Filho CD, Kappeler L, Holzenberger M. J Endocrinol (2011) 208: 119-129.
Exploring endocrine GH pattern in mice using rank plot analysis and random blood samples. Xu J, Bekaert AJ, Dupont J, Rouve S, Annesi-Maesano I, De Magalhaes Filho CD, Kappeler L, Holzenberger M. J Endocrinol (2011) 208: 119-129.
https://joe.bioscientifica.com/view/journals/joe/208/2/119.xml
 Early postnatal nutrition determines somatotropic function in mice. Kappeler L, De Magalhaes Filho C, Leneuve P, Xu J, Brunel N, Chatziantoniou C, Le Bouc Y, Holzenberger M. Endocrinology (2009) 150: 314-323.
Early postnatal nutrition determines somatotropic function in mice. Kappeler L, De Magalhaes Filho C, Leneuve P, Xu J, Brunel N, Chatziantoniou C, Le Bouc Y, Holzenberger M. Endocrinology (2009) 150: 314-323.
https://academic.oup.com/endo/article/150/1/314/2455886
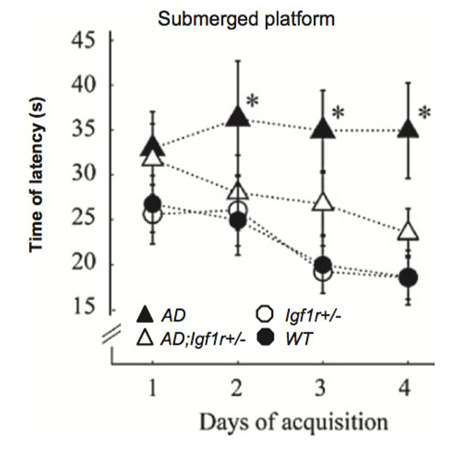 Reduced IGF-1 signaling delays age-associated proteotoxicity in mice. Cohen E, Paulsson JF, Blinder P, Burstyn-Cohen T, Du D, Estepa G, Adame A, Pham HM, Holzenberger M, Kelly JW, Masliah E, Dillin A. Cell (2009) 139: 1157-1169.
Reduced IGF-1 signaling delays age-associated proteotoxicity in mice. Cohen E, Paulsson JF, Blinder P, Burstyn-Cohen T, Du D, Estepa G, Adame A, Pham HM, Holzenberger M, Kelly JW, Masliah E, Dillin A. Cell (2009) 139: 1157-1169.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3017511/
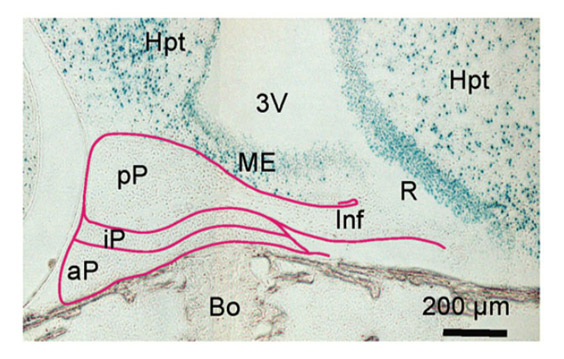 Brain IGF-1 receptors control mammalian growth and lifespan through a neuroendocrine mechanism. Kappeler L, De Magalhaes FilhoC, Dupont J, LeneuveP, Cervera P, PérinL, Loudes C, Blaise A, Klein R, Epelbaum J, Le BoucY, Holzenberger M. PLoS Biol (2008) 6: 2144-2153.
Brain IGF-1 receptors control mammalian growth and lifespan through a neuroendocrine mechanism. Kappeler L, De Magalhaes FilhoC, Dupont J, LeneuveP, Cervera P, PérinL, Loudes C, Blaise A, Klein R, Epelbaum J, Le BoucY, Holzenberger M. PLoS Biol (2008) 6: 2144-2153.
http://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.0060254
Bâtiment Kourilsky
34 rue Crozatier
75012 PARIS
Sorbonne Université
27 rue Chaligny
75012 PARIS
