


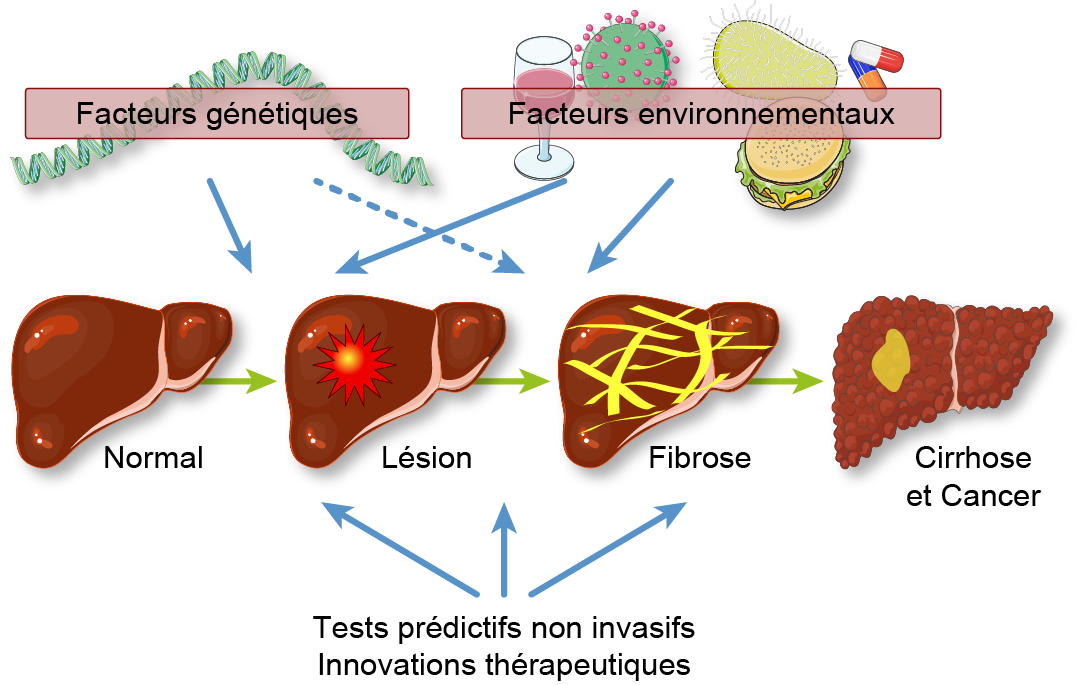
L’objectif de l’Equipe est de trouver de nouveaux mécanismes, thérapies et tests prédictifs de progression ou régression des maladies du foie, qu’il s’agisse de maladies rares comme les maladies biliaires ou très fréquentes comme les hépatites virales chroniques ou la stéatose hépatique non alcoolique (NAFLD). Des études de cohorte sont menées pour mieux définir les maladies biliaires, notamment celles causées par des anomalies génétiques du transporteur de phosphatidyl-choline, ABCB4. Les mécanismes du trafic et de la fonction d’ABCB4, l’effet des variants faux-sens et la réponse de ces variants à des agents pharmacologiques, sont analysés à l'aide d’une modélisation de la structure 3D du transporteur, de cellules polarisées et de souris transgéniques. Les mécanismes et les cibles thérapeutiques des maladies hépatiques sont étudiés à l’aide de modèles murins transgéniques, chimiques ou diététiques, avec un intérêt particulier pour les voies de mort cellulaire (nécroptose) et le rôle direct du Virus de l’Hépatite B (VHB) dans la pathogenèse. L’impact de l’homéostasie des acides biliaires et du microbiote intestinal sur les manifestations des maladies hépatiques, notamment l’encéphalopathie hépatique, est exploré dans ces modèles et chez les patients. L’origine et la fonction des myofibroblastes hépatiques impliqués dans la fibrose et le cancer du foie, sont investigués, en particulier une sous-population de myofibroblastes qui dérivent de cellules souches mésenchymateuses et favorisent l'angiogenèse. De nouveaux marqueurs de cette population cellulaire sont utilisés pour l’étude de foies fibrotiques humains et murins, des expériences de lignage et de déplétion cellulaire, chez des souris transgéniques. La contribution des myofibrobroblastes à la progression tumorale et à la résistance du cholangiocarcinome (CCA) aux thérapies ciblées est également recherchée. La recherche de traitements innovants pour le traitement du CCA est en cours. Le potentiel thérapeutique de nouvelles molécules est déterminé à l’aide des modèles précliniques et des essais cliniques chez des patients atteints de maladies biliaires, d'hépatite virale B ou de NAFLD. Des stratégies combinant des tests sérologiques (ex. Fibrotest), l’élastométrie et l’imagerie par résonance magnétique sont conçues pour évaluer la fibrose et prédire l’évolution chez ces patients. Cette recherche est intégrée à des réseaux nationaux (Filière maladie rare/Centres de Référence des maladies biliaires, Association d’étude des Cancers et Affections Biliaires (ACABi) et internationaux (iPSCsg, ENS-CCA, e-COST European CCA network).
1-GAD : Pathobiologie d'ABCB4 / ABCB4 Pathobiology
Cheffe de groupe : Dr Tounsia Aït-Slimane
Résumé: Les défauts du gène codant le transporteur canaliculaire de la phosphatidylcholine, ABCB4, provoquent des maladies cholestatiques et cholélithiasiques sévères. Les travaux de l’équipe ont permis d’identifier la majorité des variations génétiques connues à ce jour du gène ABCB4. La constitution d’une cohorte nationale RADICO permet de réaliser des études de corrélation génotype-phénotype et de Next-Generation Sequencing. La combinaison d’approches théoriques, basées sur des analyses structurales et des validations expérimentales dans des modèles cellulaires permet d’étudier l’impact des variations identifiées chez les patients et de tester des molécules pour corriger les conséquences de ces mutations pour in fine proposer une pharmacothérapie ciblée, dans une perspective de médecine personnalisée. Un autre aspect du projet vise à élucider les mécanismes moléculaires qui régulent l’expression, le trafic et la fonction d’ABCB4.
2-GAD : Aspects nécrotico-inflammatoires des maladies hépatobiliaires / Necroinflammatory aspects of hepatobiliary diseases
Chef de groupe : Dr Jérémie Gautheron
Résumé : La mort cellulaire est un facteur clé dans la progression des maladies hépatiques chroniques vers la fibrose et le cancer. Comprendre et contrôler les mécanismes de mort cellulaire est d’une importance majeure dans la mesure où cela pourrait conduire à améliorer les traitements. Découverte en 2009, la nécroptose ou nécrose programmée désigne un processus biologique de mort cellulaire qui partage la machinerie moléculaire des voies apoptotiques extrinsèques mais dont l’exécution s’apparente à la nécrose avec un gonflement de la cellule, une dilatation des organelles et une rupture de la membrane plasmique. Elle génère donc une inflammation importante et a ainsi été reliée à de nombreuses maladies avec une composante inflammatoire telles que la cholangite sclérosante primitive (CSP) et la stéatohépatite non alcoolique (NASH). Nous étudions les fonctions des médiateurs de la nécroptose dans ces maladies à l’aide de modèles murins transgéniques, de banques de tissus humains ainsi que de modèles cellulaires modifiés par la technique Crispr/Cas9. Nous testons également des inhibiteurs de la nécroptose dans le contexte de la transplantation hépatique pour réhabiliter des greffons stéatosiques à l’aide d’une machine à perfusion qui a été développée dans notre équipe.
3-GAD : Fibrose hépatique & Cirrhose / Liver fibrosis & Cirrhosis
Cheffe de groupe : Pr Chantal Housset
Résumé : La sévérité des maladies du foie quelle qu’en soit la cause est liée au développement de la fibrose hépatique dont le stade le plus avancé est la cirrhose. Nous étudions les mécanismes et cibles thérapeutiques de la fibrose à l’aide de modèles murins notamment transgéniques, de banques de tissus humains ainsi que de modèles de cellules primaires murines ou humaines. Nous visons à identifier les différentes populations de myofibroblastes hépatiques responsables de la fibrose par des approches de scRNAseq. Nous étudions leur rôle, en particulier celui d’une population que nous avons découverte de fibroblastes portaux ayant les caractéristiques de cellules souches mésenchymateuses, dans les différents aspects de la réparation tissulaire du foie, incluant fibrose, régénération et angiogenèse. Parmi les complications de la cirrhose, nous nous focalisons sur les désordres métaboliques et vasculaires responsables de l’hypertension portale et de l’encéphalopathie hépatique.
4-GAD : Cancers hépatobiliaires / Hepatobiliary cancers
Cheffe de groupe : Dr Laura Fouassier
Résumé : Les cancers du foie sont de très mauvais pronostic. Ils comprennent les carcinomes hépatocellulaires (CHC) et les cholangiocarcinomes (CCA). Le plus souvent, ils surviennent sur un terrain d’inflammation chronique liée à la consommation d’alcool, aux hépatites virales ou à la NASH, pour le CHC, aux cholangiopathies comme la cholangite sclérosante primitive, pour le CCA. Notre projet porte sur le rôle du microenvironnement tumoral (fibrose et infiltrat immunitaire) au cours de la carcinogenèse hépatique, liée notamment à l’infection par le virus de l’hépatite B (VHB). Ces travaux font appel à des modèles précliniques expérimentaux, de cultures 3D in vitro et de souris transgéniques ou de xénogreffes in vivo, ainsi qu’à des études cliniques. Nous développons également des tests non invasifs de prédiction des cancers du foie. Notre recherche nous conduit ainsi à proposer des stratégies innovantes de prise en charge des cancers du foie, par des approches interdisciplinaires.
maladies biliaires / stéatite-hépatite non alcoolique / fibrose hépatique / cholangiocarcinome / necroptose / transporteur ABCB4 /hépatites virales / Human HepCell
labellisation Fondation pour la Recherche Médicale (FRM 2020 n°EQU202003010517) : Innovations en biologie, à visée thérapeutique, dans les cholangiopathies fibrosantes
Articles
Ivacaftor-Mediated Potentiation of ABCB4 Missense Mutations Affecting Critical Motifs of the NBDs: Repositioning Perspectives for Hepatobiliary Diseases.
Jean-Louis Delaunay , Ahmad Elbahnsi, Alix Bruneau, Claire Madry, Anne-Marie Durand-Schneider , Anne Stary , Chantal Housset , Jérémie Gautheron, Isabelle Callebaut, Tounsia Aït-Slimane.
Int J Mol Sci. (2023).
Cold plasma endoscopy applied to biliary ducts: feasibility risk assessment on human-like and porcine models for the treatment of cholangiocarcinoma
H Decauchy, A Pavy, M Camus, L Fouassier*, T Dufour*. * co-leadership.
Journal of Physics D: Applied Physics (2022).
Protective potential of the gallbladder in primary sclerosing cholangitis.
N. Cazzagon,# E. Gonzalez-Sanchez,# H. El-Mourabit, D. Wendum, D. Rainteau, L. Humbert, C. Corpechot, O.Chazouillères, L. Arrivé,* C. Housset,* S. Lemoinne* (*Co-senior).
JHEP Rep (2022).
The necroptosis-inducing pseudokinase mixed lineage kinase domain-like regulates the adipogenic differentiation of pre-adipocytes.
J. Magusto, C. Beaupère, M.B. Afonso, M. Auclair, J.L. Delaunay, P-A. Soret, G. Courtois, T. Aït-Slimane, C. Housset, I. Jéru, B. Fève, V. Ratziu, C.M.P. Rodrigues, J. Gautheron.
iScience (2022).
Diversity of the nucleic acid forms of circulating HBV in chronically infected patients and its impact on viral cycle.
A. Schnuriger, P. Soussan, J. Sotty, P. Bablon, B. Lekbaby, J. Augustin, M. Girier-Dufournier, L. Langlois, C. Dorival, F. Carrat, S. Pol, H. Fontaine, N. Sarica, C. Neuveut, C. Housset, D. Kremdsorf.
Hepatol Int (2022).
ATP-binding cassette transporters expression in rats with cirrhosis and hepatic encephalopathy.
C. Bouzbib, H. El Mourabit, D. Wendum, E. Lasnier, S. Mouri, C. Housset, D. Thabut, N. Weiss, M. Rudler.
Clin Res Hepatol Gastroenterol (2022).
A systemic mechanism of increased transendothelial migration of leukocytes through the blood-brain barrier in hepatic encephalopathy.
A. Schaefer, M. Journaux, H. El Mourabit, S. Mouri, D. Wendum, E. Lasnier, P.O. Couraud, C. Housset, D. Thabut, M. Rudler, N. Weiss.
Clin Res Hepatol Gastroenterol (2022).
Portal fibroblasts with mesenchymal stem cell features form a reservoir of proliferative myofibroblasts in liver fibrosis.
L. Lei, A. Bruneau, H. El Mourabit, J. Guegan, T. Folseraas, S. Lemoinne, T. H. Karlsen, B. Hoareau, R. Morichon, E. Gonzalez-Sanchez, C. Goumard, V. Ratziu, P. Charbord, J. Gautheron, F. Tacke, T. Jaffredo, A. Cadoret, C. Housset.
Hepatology (2022).
Loss of thymidine phosphorylase activity disrupts adipocyte differentiation and induces insulin-resistant lipoatrophic diabetes.
J. Gautheron, L. Lima, B. Akinci, J. Zammouri, M. Auclair, S. K. Ucar, S. Ozen, C. Altay, B. E. Bax, I. Nemazanyy, V. Lenoir, C. Prip-Buus, C. Acquaviva-Bourdain, O. Lascols, B. Feve, C. Vigouroux, E. Noel, I.Jeru.
BMC Med (2022).
MRCK-Alpha and Its Effector Myosin II Regulatory Light Chain Bind ABCB4 and Regulate Its Membrane Expression.
A. Bruneau, J.L. Delaunay, A.M. Durand-Schneider, V. Vauthier, A. Ben Saad, L. Aoudjehane, H. El Mourabit, R. Morichon, T. Falguieres, J. Gautheron, C. Housset, T. Ait-Slimane.
Cells (2022).
Liver stiffness measurement by vibration-controlled transient elastography improves outcome prediction in primary biliary cholangitis.
C. Corpechot, F. Carrat, F. Gaouar, F. Chau, G. Hirschfield, A. Gulamhusein, A. J. Montano-Loza, E. Lytvyak, C. Schramm, A. Pares, I. Olivas, J. E. Eaton, K. T. Osman, G. Dalekos, N. Gatselis, F. Nevens, N. Cazzagon, A. Zago, F. P. Russo, N. Abbas, P. Trivedi, D. Thorburn, F. Saffioti, L. Barkai, D. Roccarina, V. Calvaruso, A. Fichera, A. Delamarre, E. Medina-Morales, A. Bonder, V. Patwardhan, C. Rigamonti, M. Carbone, P. Invernizzi, L. Cristoferi, A. van der Meer, R. de Veer, E. Zigmond, E. Yehezkel, A. E. Kremer, A. Deibel, J. Dumortier, T. Bruns, K. Grosse, G. P. Pageaux, A. Wetten, J. Dyson, D. Jones, O. Chazouilleres, B. Hansen, V. de Ledinghen, Global, E. R. N. R.-L. P. S. Groups.
J Hepatol (2022).
Combination of fibrates with obeticholic acid is able to normalise biochemical liver tests in patients with difficult-to-treat primary biliary cholangitis.
P. A. Soret, L. Lam, F. Carrat, L. Smets, T. Berg, M. Carbone, P. Invernizzi, V. Leroy, P. Trivedi, N. Cazzagon, C. Weiler-Normann, L. Alric, I. Rosa-Hezode, A. Heurgue, J. P. Cervoni, J. Dumortier, P. Potier, O. Roux, C. Silvain, C. Bureau, R. Anty, D. Larrey, C. Levy, A. Pares, C. Schramm, F. Nevens, O. Chazouilleres, C. Corpechot.
Aliment Pharmacol Ther (2021).
EPHX1 mutations cause a lipoatrophic diabetes syndrome due to impaired epoxide hydrolysis and increased cellular senescence.
J. Gautheron, C. Morisseau, W. K. Chung, J. Zammouri, M. Auclair, G. Baujat, E. Capel, C. Moulin, Y. Wang, J. Yang, B. D. Hammock, B. Cerame, F. Phan, B. Feve, C. Vigouroux, F. Andreelli, I. Jeru.
Elife (2021).
Zinc Finger E-Box Binding Homeobox 1 Promotes Cholangiocarcinoma Progression Through Tumor Dedifferentiation and Tumor-Stroma Paracrine Signaling.
C. Lobe, M. Vallette, A. Arbelaiz, E. Gonzalez-Sanchez, L. Izquierdo, A. Pellat, N. Guedj, C. Louis, V. Paradis, J. M. Banales, C. Coulouarn, C. Housset, J. Vaquero, L. Fouassier.
Hepatology (2021).
Low-phospholipid-associated cholelithiasis syndrome: Prevalence, clinical features, and comorbidities.
C. Dong, B. Condat, M. Picon-Coste, Y. Chretien, P. Potier, B. Noblinski, L. Arrive, M. P. Hauuy, V. Barbu, A. Maftouh, F. Gaouar, K. Ben Belkacem, C. Housset, R. Poupon, D. Zanditenas, O. Chazouilleres, C. Corpechot.
JHEP Rep (2021).
Inhibition of receptor-interacting protein kinase 1 improves experimental non-alcoholic fatty liver disease.
A. Majdi, L. Aoudjehane, V. Ratziu, T. Islam, M. B. Afonso, F. Conti, T. Mestiri, M. Lagouge, F. Foufelle, F. Ballenghien, T. Ledent, M. Moldes, A. Cadoret, L. Fouassier, J.L. Delaunay, T. Ait-Slimane, G. Courtois, B. Feve, O. Scatton, C. Prip-Buus, C. M. P. Rodrigues, C. Housset, J. Gautheron.
J Hepatol (2020).
Novel defatting strategies reduce lipid accumulation in primary human culture models of liver steatosis.
L. Aoudjehane, J. Gautheron, W. Le Goff, C. Goumard, J. Gilaizeau, C. S. Nget, E. Savier, M. Atif, P. Lesnik, R. Morichon, Y. Chretien, Y. Calmus, O. Scatton, C. Housset, F. Conti.
Dis Model Mech (2020).
Cold-Atmospheric Plasma Induces Tumor Cell Death in Preclinical In Vivo and In Vitro Models of Human Cholangiocarcinoma.
J. Vaquero, F. Judee, M. Vallette, H. Decauchy, A. Arbelaiz, L. Aoudjehane, O. Scatton, E. Gonzalez-Sanchez, F. Merabtene, J. Augustin, C. Housset, T. Dufour, L. Fouassier.
Cancers (Basel) (2020).
Fungi participate in the dysbiosis of gut microbiota in patients with primary sclerosing cholangitis.
S. Lemoinne, A. Kemgang, K. Ben Belkacem, M. Straube, S. Jegou, C. Corpechot, I.B.D.N. Saint-Antoine, O. Chazouilleres, C. Housset, H. Sokol.
Gut (2020).
A Placebo-Controlled Trial of Bezafibrate in Primary Biliary Cholangitis.
C. Corpechot, O. Chazouilleres, A. Rousseau, A. Le Gruyer, F. Habersetzer, P. Mathurin, O. Goria, P. Potier, A. Minello, C. Silvain, A. Abergel, M. Debette-Gratien, D. Larrey, O. Roux, J. P. Bronowicki, J. Boursier, V. de Ledinghen, A. Heurgue-Berlot, E. Nguyen-Khac, F. Zoulim, I. Ollivier-Hourmand, J. P. Zarski, G. Nkontchou, S. Lemoinne, L. Humbert, D. Rainteau, G. Lefevre, L. de Chaisemartin, S. Chollet-Martin, F. Gaouar, F. H. Admane, T. Simon, R. Poupon.
N Engl J Med (2018).
Functional defect of variants in the adenosine triphosphate-binding sites of ABCB4 and their rescue by the cystic fibrosis transmembrane conductance regulator potentiator, ivacaftor (VX-770).
J.L. Delaunay, A. Bruneau, B. Hoffmann, A.M. Durand-Schneider, V. Barbu, E. Jacquemin, M. Maurice, C. Housset, I. Callebaut, T. Ait-Slimane.
Hepatology (2017).
Criteria for preclinical models of cholangiocarcinoma: scientific and medical relevance.
D.F. Calvisi, L. Boulter, J. Vaquero, A. Saborowski, L. Fabris, P. Rodrigues, C. Coulouarn, R. Castro, O. Segatto, C. Raggi, L. van der Laan, G. Carpino, B. Goeppert, S. Roessler, T. Kendall, M. Evert, E. Gonzalez-Sanchez, J. Valle, A. Vogel, J. Bridgewater, M. Borad, G. Gores, L. Roberts, J. Marin, J. Andersen, D. Alvaro, A. Forner, J. Banales, V. Cardinale, R. Macias, S. Vicent, X. Chen, C. Braconi, M. Verstegen, L. Fouassier.
Nat Rev Gastroenterol Hepatol. (2023).
Targeting the complexity of ERBB2 biology in gastroesophageal adenocarcinomas.
J Augustin, P Soussan, A.J. Bass.
Annals of Oncology (2022).
Alternative splicing of viral transcripts: the dark side of HBV.
D. Kremsdorf, B. Lekbaby, P. Bablon, J. Sotty, J. Augustin, A. Schnuriger, J. Pol, P. Soussan.
Gut (2021).
Lytic cell death in metabolic liver disease.
J. Gautheron, G. J. Gores, C. M. P. Rodrigues.
J Hepatol (2020).
Genetic alterations shaping tumor response to anti-EGFR therapies.
J Vaquero, A Pavy, E Gonzalez-Sanchez, M Meredith, A Arbelaiz, L Fouassier.
Drug Resistance Update (2022).
Role of Angiogenesis in the Pathogenesis of NAFLD.
L. Lei, H. Ei Mourabit, C. Housset, A. Cadoret, S. Lemoinne.
J Clin Med (2021).
In Vitro and In Vivo Models of Non-Alcoholic Fatty Liver Disease: A Critical Appraisal.
P. A. Soret, J. Magusto, C. Housset, J. Gautheron.
J Clin Med (2020).
Hepatic encephalopathy: Another brick in the wall.
N. Weiss, C. Housset, D. Thabut.
J Hepatol (2019).
New treatments/targets for primary biliary cholangitis.
C. Corpechot, R. Poupon, O. Chazouilleres.
JHEP Rep (2019).
Bâtiment Kourilsky
34 rue Crozatier
75012 PARIS
Sorbonne Université
27 rue Chaligny
75012 PARIS
