
Hôpital Saint-Antoine - Bâtiment Kourilsky - 5ème étage - 184, rue du Faubourg Saint-Antoine, 75012 Paris, France
La Rhumatologie à Saint-Antoine : LaRhumato.fr
Recherches sur l'arthrose
L'arthrose, une maladie affectant principalement les articulations périphériques et le rachis, touche 6 millions de personnes en France, avec une prévalence mondiale de la maladie estimée récemment à plus de 250 millions d'habitants. Globalement, l'arthrose périphérique/rachidienne est la cause la plus fréquente d'invalidité avec des dépenses médicales annuelles dépassant 3,4 milliards €, soit un doublement en 10 ans. Le principal symptôme de l’arthrose sont les douleurs qui peuvent mettre en jeu différents mécanismes (douleur nociceptive, douleur neuropathique, sensibilisation centrale). Ce symptôme reste mal compris ce d’autant plus qu’il peut être en partie imparfaitement corrélé des altérations tissulaires articulaires.
Malheureusement, les seules stratégies de traitement cliniquement reconnues sont à visée symptomatique, et aucun médicament à visée structurale contre l'arthrose n'est approuvé. Un traitement efficace de l'arthrose est donc un besoin critique non satisfait.
Notre équipe regroupe des physiologistes, des biologistes cellulaires, des biochimistes, des bioinformaticiens, des rhumatologues et des chirurgiens orthopédistes qui se consacrent à la recherche de nouvelles cibles thérapeutiques contre l'arthrose. Pour cet objectif, nous tirons profit des connaissances récentes sur la pathophysiologie de la maladie :
• L'arthrose a d'abord été considérée comme une affection uniquement cartilagineuse. Nous savons maintenant que l'arthrose est une maladie beaucoup plus complexe, qui touche non seulement le cartilage, mais aussi les os et le tissu synovial. En effet, des études suggèrent que la progression structurale de l'arthrose peut résulter d'une altération de la communication entre les cellules osseuses sous-chondrales (p. ex. ostéoblastes, ostéocytes, cellules endothéliales, adipocyte), les chondrocytes et les synoviocytes.
• Étant donné que l'obésité et les maladies cardiométaboliques sont des facteurs de risque d'arthrose non seulement pour les articulations portantes mais aussi pour les mains, les médiateurs systémiques et l'inflammation systémique de bas grade jouent certainement un rôle critique dans l'initiation et/ou l'aggravation de l'arthrose et dans la douleur. Cette inflammation peut être modulée par des facteurs environnementaux, le microbiote intestinal et par le système nerveux autonome.
Sur la base de ces découvertes récentes, nos principaux projets actuellement à l'étude sont :
• Trouver de nouveaux médiateurs impliqués dans la communication perturbée entre le cartilage et l'os sous-chondral dans un objectif de moduler leur expression à but thérapeutique.
• Déterminer le rôle des signaux inflammatoires/métaboliques/neuronaux externes sur les anomalies de communications intertissulaires qui pourraient être manipulées à des fins thérapeutiques
• Déterminer les acteurs moléculaires impliqués dans la douleur articulaire, principal symptôme de l’arthrose
• Etudier le rôle des facteurs environnementaux tels que les perturbateurs endocriniens dans la génèse de l’arthrose .
Méthodologies utilisées :
• Modèles expérimentaux d'arthrose (souris) (collagénase, déstabilisation méniscale, vieillissement)
• Culture primaire de chondrocytes articulaires (souris, humain) et chondrocytes costals (souris), d'ostéoblastes humains et murins (membrane 3D), de synoviocytes humains et de cellules souches mésenchymateuses (issues de moelle osseuse et de tissus adipeux humains et de rats).
• Contrôle du phénotype des chondrocytes (différenciation hypertrophique et dé-différenciation fibroblastique)
• Modèle de communication os/cartilage (murin)
• Différenciation de cellules souches mésenchymateuses en chondrocytes, ostéoblastes et adipocytes
• Tests cellulaires (prolifération, adhérence, angiogenèse)
• Analyse cellulaire (Western-blot, activité protéolytique, ELISA, qRT-PCR, interférence ARN, immunocytologie)
• Biobanque BioJoint de tissus humains arthrosiques pour des analyses tissulaires, cellulaires, biochimiques et moléculaires
• Cohorte de patients arthrosique suivis longitudinalement avec recueil de données cliniques, biologiques et d’imagerie
• Analyse tissulaire (histologie, immunohistochimie)
• Analyse bioinformatique
Faits les plus marquants :
1 - Trouver de nouveaux médiateurs impliqués dans la communication perturbée entre le cartilage et l'os sous-chondral dans un objectif de moduler leur expression à but thérapeutique.
Il existe un profond remodelage de la jonction ostéochondrale au cours de l’arthrose à l’origine de la disparition du cartilage articulaire et de la sclérose de l’os sous-chondral. Ce remodelage peut s’expliquer par une réactivation pathologique du processus d’ossification endochondrale qui inclut, une différenciation hypertrophique des chondrocytes, une minéralisation du cartilage, une angiogenèse augmentée et une résorption suivie d’une synthèse osseuse.
Le projet s’intéresse à déterminer les acteurs cellulaires et moléculaires à l’origine de ce remodelage pathologique. Dans le volet cartilagineux, nous nous intéressons à la différenciation hypertrophique des chondrocytes ; aux facteurs qui interviennent dans cette différenciation (projet collaboratif financé par la SFR) et à ceux produits par les chondrocytes hypertrophiques et qui pourraient stimuler l’angiogenèse et l’ostéoclastogenèse (financement ARDoC de la thèse d’I. Toillon). Dans le volet osseux, nous étudions les conséquences d’un stress mécanique excessif sur l’activité angiogénique des ostéoblastes. Nous étudions également le rôle que pourraient jouer les cellules du tissu adipeux médullaire (adipocytes et cellules stromales mésenchymateuses) (financement appel d’offre SFR Network et financement FRM du postdoc de N. Zapata). Nos données publiées (Eymard, Arthritis Rheumatol 2014 ; Eymard, Ann Rheum Dis 2017) et en cours d’écriture suggèrent en effet que les tissus adipeux intra-articulaires sont de nouveaux acteurs tissulaires impliqués dans l’arthrose (financement Ramsay Générale de Santé). Enfin, nous développons en collaboration avec un chimiste (Dr. J. Landoulsi) une nouvelle approche par microscopie à force atomique de l’analyse des modifications de la structure de la jonction ostéochondrale dans l’arthrose (financement IPV – Sorbonne Université de la thèse d’I. Jaabar).
Protéine 14-3-3 : Récemment, des études ont montré l'implication de l’immunité innée et de l'inflammation dans la progression de l'arthrose. Notre équipe a identifié la protéine 14-3-3ε comme nouveau facteur catabolique, produit par l'os sous-chondral et capable d'induire un phénotype catabolique sur les chondrocytes. Nous avons découvert que ces effets sont médiés, au moins en partie, par la signalisation via les récepteurs TLR2 ou TLR4, conduisant à l'activation de l'immunité innée comme le font les alarmines. De plus, il est établi que les alarmines peuvent stimuler l'activation des cellules immunitaires résidentes de la membrane synoviale, en particulier des macrophages conduisant à l’inflammation synoviale. Nous avons pu montrer que la polarisation des macrophages stimulés par 14-3-3ε semble les orienter vers un phénotype inflammatoire M1. Ainsi, nos résultats désignent 14-3-3ε comme une nouvelle alarmine dans l'arthrose, déclenchant des effets cataboliques et inflammatoires via la signalisation des TLRs. Ce nouveau candidat pourrait représenter une nouvelle cible à des fins thérapeutiques et / ou pronostiques.
S. Priam, C. Bougault, X. Houard, C. Salvat, M. Gosset, F. Berenbaum and C. Jacques. Identification of soluble 14-3-3 as a novel subchondral bone mediator involved in cartilage degradation in osteoarthritis. Arthritis and Rheumatism. 2013 Jul;65(7):1831-42.
Nefla M, Sudre L, Denat G, Priam S, Andre-Leroux G, Berenbaum F, Jacques C. The pro-inflammatory cytokine s14-3-3ε is a ligand of CD13/Aminopeptidase N in cartilage. J Cell Sci. 2015 Sep 1;128(17):3250-62.
Nefla M, Holzinger D, Berenbaum F and Jacques C. The danger from within: alarmins in arthritis. Nat Rev Rheumatol. 2016 12(11):669- 683.
Eymard F, Pigenet A, Citadelle D, Tordjman J, Foucher L, Rose C, Flouzat Lachaniette CH, Clément K, Berenbaum F, Chevalier X, Houard X. Knee and hip intra-articular adipose tissues (IAATs): a common phenotype for a central player in osteoarthritis. Ann. Rheum Dis. 2017;76(6):1142-48.
Eymard F, Pigenet A, Citadelle D, Flouzat-Lachaniette CH, Poignard A, Benelli C, Berenbaum F, Chevalier X, Houard X. Infrapatellar fat pad induces an inflammatory and pro-degradative phenotype on autologous fibroblast-like synoviocytes from severe knee osteoarthritis patients. Arthritis Rheumatol. 2014; 66(8):2165-74.
2 - Déterminer le rôle du système cholinergique et de sa manipulation à des fins thérapeutiques.
Nous avons également une vision intégrative de la pathophysiologie de l'arthrose. En substance, nous étudions le rôle du système nerveux autonome (et en particulier de son principal médiateur, l'acétylcholine) dans la physiopathologie l'arthrose et l’inflammation articulaire. A l’aide d'une méthode récente qui utilise un protocole d'immunomarquage 3D de l'ensemble de l'articulation, nous avons démontré une innervation cholinergique des tissus articulaires (os sous-chondral et synovial) dans des échantillons articulaires humains et murins (collaboration avec Alain CHEDOTAL Institut de la Vision, INSERM, Paris, France). Nous cherchons aussi à déterminer si les chondrocytes et les ostéoblastes sont capables de produire eux-mêmes de l'acétylcholine (correspondant à une production non neuronale de l'acétylcholine) et si l’axe acétylcholine/récepteurs de l’acétylcholine (récepteur alpha-7 nicotinique (Chrna7)) peut réguler l'inflammation articulaire 7 (collaboration avec Uwe MASKOS, Unité de neurobiologie intégrative des systèmes cholinergiques, CNRS UMR 3571, Institut Pasteur, Paris, France). Nous avons ainsi montér que l’axe acétymholine/ récepteur alpha-7 nicotinique module la réponse inflammatioire et la dégradation des tissus articulaires. Ceci nous a conduit à essayer d la stimulaiton auriculaire du nerf vague dans l’arthrose des mains douloureuse et inflammatoire dans le cadre d’un PHRC.
Courties A, Olmer M, Myers K, Ordoukhanian P, Head SR, Natarajan P, Berenbaum F, Sellam J, Lotz MK.Human-specific duplicate CHRFAM7A gene is associated with more severe osteoarthritis and amplifies pain behaviours. Ann Rheum Dis. 2023 Jan 10:ard-2022-223470.
Courties A, Petit J, Do A, Legris M, Kouki I, Pigenet A, Sacitharan PK, Ehkirch FP, Berenbaum F, Sellam J. Alpha-7 Nicotinic Receptor Dampens Murine Osteoblastic Response to Inflammation and Age-Related Osteoarthritis.Front Immunol. 2022 Apr 8;13:842538.
Courties A, Do A, Leite S, Legris M, Sudre L, Pigenet A, Petit J, Nourissat G, Cambon-Binder A, Maskos U, Berenbaum F, Sellam J.The Role of the Non-neuronal Cholinergic System in Inflammation and Degradation Processes in Osteoarthritis. Arthritis Rheumatol. 2020 Jul 8. doi: 10.1002/art.41429. Online ahead of print.
Courties A, Belle M, Senay S, Cambon-Binder A, Sautet A, Chédotal A, Berenbaum F, Sellam J.Clearing method for 3-dimensional immunofluorescence of osteoarthritic subchondral human bone reveals peripheral cholinergic nerves. Sci Rep. 2020 Jun 1;10(1):8852.
Courties A, Sellam J, Berenbaum F. Role of the autonomic nervous system in osteoarthritis. Best Pract Res Clin Rheumatol. 2017 Oct;31(5):661-675
Au niveau cellulaire :
• Culture primaire de chondrocytes articulaires (souris, humain) et chondrocytes costaux (souris), d'ostéoblastes humains et murins (membrane 3D), de synoviocytes humains, de macrophages, de cellules souches mésenchymateuses (issues de moelle osseuse et de tissus adipeux humains et de rats), de cellules endothéliales
• Contrôle du phénotype des chondrocytes (différenciation hypertrophique et dé-différenciation fibroblastique)
• Tests cellulaires (prolifération, adhérence, angiogenèse)
• Analyse cellulaire (Western-blot, activité protéolytique, ELISA, qRT-PCR, interférence ARN, immunocytologie)
Au niveau tissulaire :
• Culture d’explants de cartilage, histologie, immunohistochimie , biochimie et analyse moléculaire des tissus de l’articulation.
Modèles in vivo :
Modèle expérimentaux d’arthrose chez la souris et le rat (post-traumatique, monoiodoacétate, collagénase)
Données chez l’Humain :
• BioJoint : Biobanque de tissus humains arthrosiques (cartilage, os, tissu synovial et liquide synovial, tissu adipeux) pour des analyses tissulaires, cellulaires, biochimiques et moléculaires.
• DIGICOD : une cohorte de 426 patients ayant une arthrose des mains (phénotypage clinique, ADN, serum, Radiographies, IRM, échographies)
• TRANSIMMUNOM : une cohorte de patients souffrant de maladies inflammatoires incluant 50 arthrose du genou.
Collaborations internationales :
• Hong Kong (Polytechnic University)
• San Diego (Scripps Institute)
• San Francisco (USDF Bakar Institute)
Mots-Clés :
• arthrose
• inflammation
• tissu adipeux
• système cholinergique
• cartilage
• tissu synovial
• os sous-chondral
• modèles murins d’ arthrose
• culture in vitro/ex vivo de cellules de l’articulation
• modèles de différenciation des chondrocytes
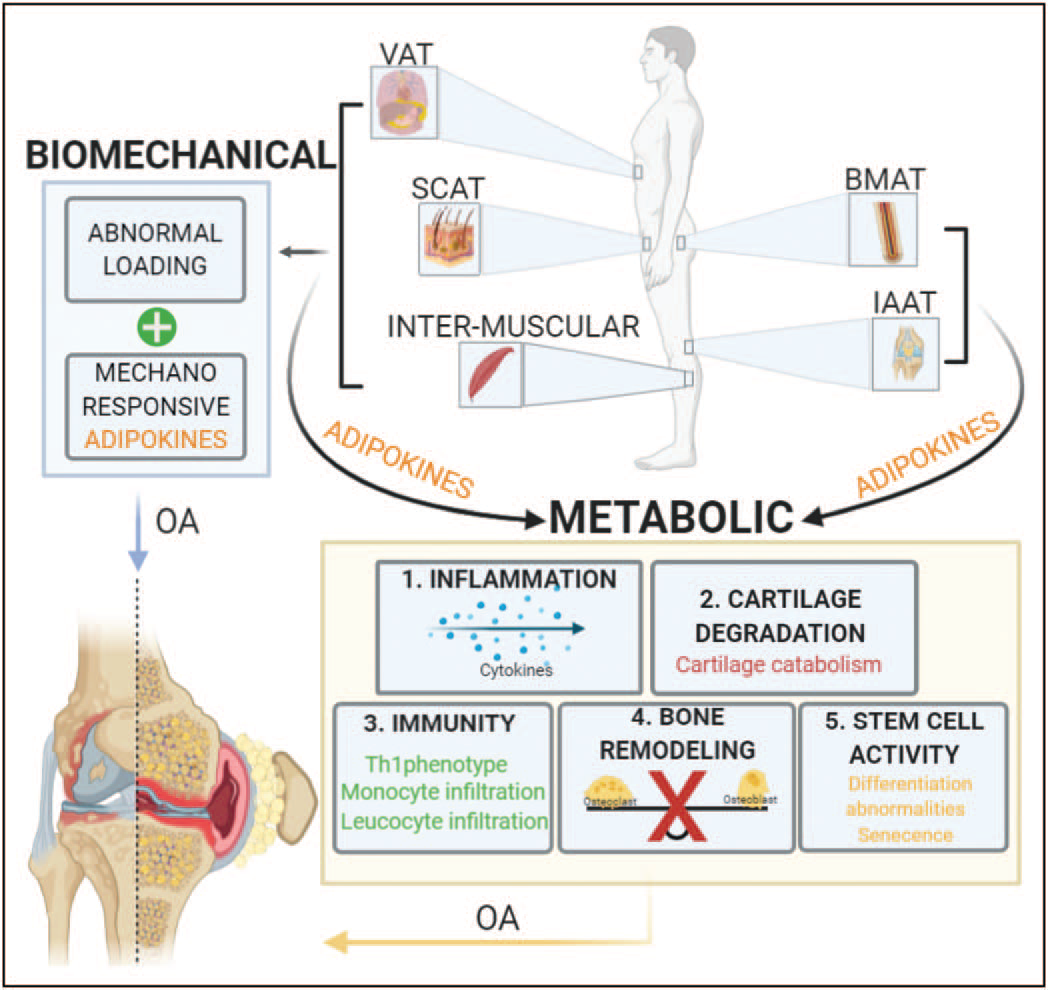
Roles of the different adipose tissues on osteoarthritis progression by biomechanical and metabolic mechanisms. Increases on systemic adipose tissues like subcutaneous adipose tissue, visceral adipose tissue and intra-muscular adipose tissue contribute to abnormal loading of the joint, this mechanical stress have been shown to be part of osteoarthritis onset and progression. Lipocalin adipokine family has emerged as sensors of mechanical load, inflammatory status and catabolic stimuli of the joint, suggesting its involvement in osteoarthritis pathophysiology. On the other hand, the paracrine role of subcutaneous adipose tissue, visceral adipose tissues, intra muscular adipose tissues and local adipose tissues bone marrow adipose tissue and intra-articular adipose tissue affect joint health. The adipokines secreted by all those tissues have proven to promote directly: 1. Secretion of inflammatory cytokines like IL-1b and TNF-a which are well documented for their active involvement in the pathophysiology of osteoarthritis, 2. Cartilage catabolism, including inhibition of proliferation in chondrocytes and degradation of the matrix components, collagen type 2 and agrecan, 3. Immune response by the infiltration of joint tissues by monocytes and leucocytes which increases even more the inflmmatory signals present on the joint affected, 4. Loss of balance between osteoclast and osteoblast affecting directly bone remodelling, changes on bone constitution are part of osteoarthritis pathophysiology and 5. Changes on stem-cell principal characteristics like prolifereation and differentiation capacity.
From Curr Opin Rheumatol 2021, 33:84–93
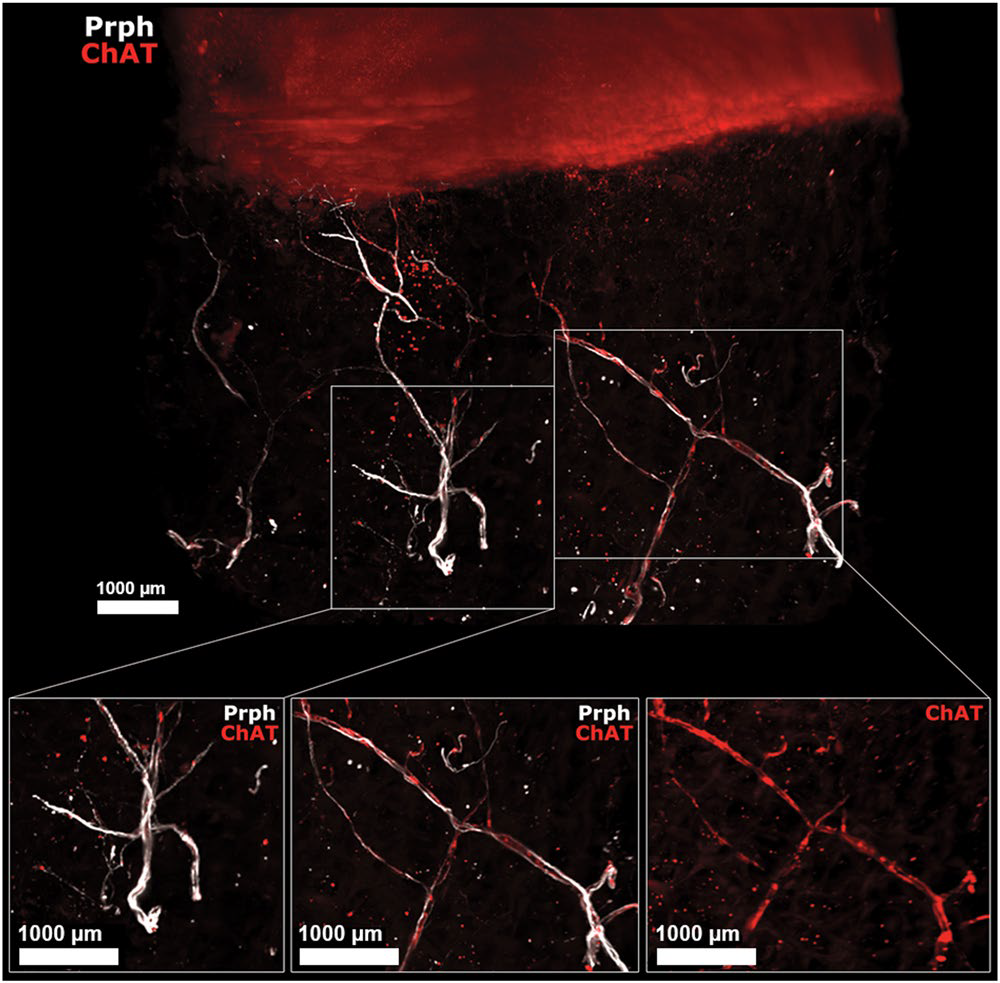
Human OA subchondral bone has peripheral and cholinergic nerves. Immunofluorescence of peripherin and ChAT in human OA subchondral bone (see video 2) after the 3DISCO clearing protocol and analysis with Imaris. The colocalization of both markers showed that some subchondral bone peripheral nerves marked by Prph (white) are also cholinergic, as they showed ChAT immunofluorescence (red) as shown on the right while some did not expressed ChAT (left). ChAT: choline acetyltransferase, Prph: peripherin.
From Scientific Reports | (2020) 10:8852
Bâtiment Kourilsky
34 rue Crozatier
75012 PARIS
Sorbonne Université
27 rue Chaligny
75012 PARIS
